黄建教授与邱福铭教授团队合作揭示肠道微生态在炎性驱动大肠癌中的关键作用
在国家自然科学基金项目等资助下,浙江大学医学院附属第二医院、浙江省肿瘤微环境与免疫治疗重点实验室黄建教授团队与邱福铭教授团队合作,一直围绕微生态-免疫微环境-肿瘤演进相关性,揭示了肠道微生态在炎性驱动肠癌中的关键作用及机制。近期研究结果以“肠道菌群与肠道单核细胞样巨噬细胞互作以促进肠炎相关肿瘤发生(Cross-talk between the gut microbiota and monocyte-like macrophages mediates an inflammatory response to promote colitis-associated tumourigenesis)”为题在线发表在国际知名消化杂志GUT上(http://dx.doi.org/10.1136/gutjnl-2020-320777),邱福铭和黄建为共同通讯作者。
2015年,团队在黄建教授的带领下,发现了多核型髓源抑制性细胞在人体大肠癌炎性微环境中具有的重要免疫抑制作用,以封面论文形式发表于免疫学领域的国际顶级专业期刊Immunity杂志(https://doi.org/10.1016/j.immuni.2014.03.013)。之后团队长期致力于肠道免疫微环境的研究,在国家自然科学基金等资助下,在领域内专业期刊(Cellular & Molecular Immunology, Oncoimmunology, Frontiers in immunology)上发表多篇论文。
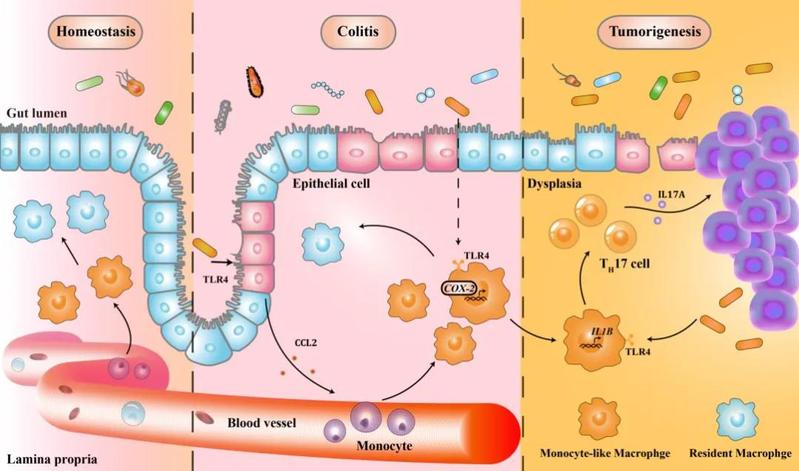
图 肠道菌群协同单核样巨噬细胞促进肠炎相关肿瘤发生的机制
肠道是人体最大的微生态系统。流行病学显示,肠道慢性炎症会增加结直肠癌的发病率。炎症性肠病,尤其是溃疡性结肠炎,已被认为是结直肠癌的易感因素。近年来,学者们关注到异常的肠道微生态(肠道菌群失调、免疫细胞大量聚集)是引起结直肠癌发生的重要因素之一,但对于肠道细菌具体如何作用于肠道异常富集的免疫细胞、又是如何进一步影响肠炎相关肿瘤形成仍知之甚少。在黄建教授和邱福铭教授的指导下,团队经过5年的摸索与深入研究,发现肠道内微生物与肠道异常的免疫功能是引起肠癌进展的关键原因。
该研究利用经典的小鼠肠炎相关肿瘤AOM-DSS模型,通过一系列研究发现:单核样巨噬细胞在肠炎相关肿瘤发生的早期阶段特异性富集,该亚群具有强分泌炎症因子的作用。进一步研究发现,肠道菌群在小鼠肠炎相关肿瘤发生过程中呈阶段性改变,广谱抗生素耗竭肠道菌群后可明显减少上述单核样巨噬细胞的积聚,粪便移植实验更是反向验证了其二者的重要性及相关性;而后研究人员通过一系列体内外实验阐明了“细菌代谢产物LPS-肠上皮CCL2-单核样巨噬细胞-Th17细胞” 这一由外向内多线程的复杂调控网机制,为肠道菌群干预肠道肿瘤的发生发展提供了重要理论依据。研究人员通过人类肠道宏基因组大数据分析进一步发现,在人肠炎相关肿瘤发生过程中可能存在类似机制——相比于健康人群,溃疡性结肠炎、结直肠癌患者肠道中产LPS细菌增多;结合转录组数据进一步揭示了免疫细胞与细菌代谢产物的相互作用,构成了肿瘤内互作网络的核心。
该研究系统性阐述了肠道菌群作用于肠道免疫应答从而调控肠道肿瘤发生的机制,为充分阐明人肠炎相关肿瘤中菌群-免疫互作的潜在机制奠定了科学基础,并为开发基于联合靶向微生态与微环境的免疫治疗提供了新思路与新策略。
来源:浙江大学医学院公众号


